La base fisiológica en la formación de frutos en cerezo dulce, considerando la rapidez de sus avances fenológicos desde plena flor hasta cosecha, sugiere tener la máxima atención para suplir las necesidades de labores culturales y nutricionales para ser exitosos.
Muchos especialistas coinciden que este trabajo permanente, conectado desde la temporada anterior, con foco principal en la recuperación nutricional de los árboles en función de la extracción de nutrientes por la fruta y además tratando de maximizar el trabajo de la planta para la captación continua de CO2 desde el ambiente, que es la base para la acumulación de azucares de reserva. Este trabajo apunta prácticamente a evitar un inminente estrés térmico/hídrico y cierre estomático en las plantas durante el verano.
El desarrollo del fruto es muy rápido, y se reconocen variedades de ciclo corto, con incluso 45 días desde plena flor a cosecha. Este recorrido se conoce como la “carrera perfecta”, donde cada descuido puede ser un detonante para no lograr el máximo potencial.
Ya en la temporada, los programas nutricionales, tanto foliares como de suelo son una base importante para poder maximizar el desarrollo de fruto y de follaje, y lograr el máximo potencial. Estos programas deben ajustarse a las características específicas de cada combinación de variedad/portainjerto ya que en la práctica se reconocen claras diferencias en demanda de distintos nutrientes y de algunas necesidades particulares de cada una de ellas.
Complementario a los programas nutricionales, está la utilización de reguladores de crecimiento o PGR, por sus siglas en inglés (Plant Grow Regulator), que son parte de acciones específicas principalmente para potenciar la formación de frutos en las distintas fases de su desarrollo (Fig. 1).
Hay que recordar que siempre lo más importante es asegurar equilibrio en las plantas en términos de manejos técnico/culturales, mantener un adecuado nivel de reservas, un óptimo desarrollo vegetativo, regulación de carga acorde al potencial del huerto y un perfecto manejo hídrico.
Figura 1. Dinámica del crecimiento de fruto del cerezo representado por la curva doble sigmoidea y la relación con las distintas fitohormonas más importantes que influyen en su desarrollo. Carlos J. Tapia T. 2016.
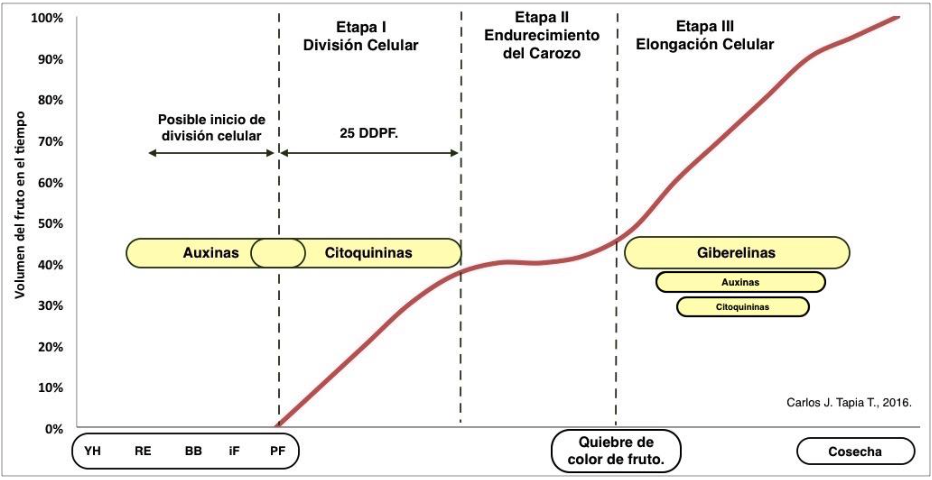
Si se ajusta este análisis solamente al desarrollo del fruto previo a la fecundación de flores y posterior desarrollo hasta cosecha, podemos reconocer un constante trabajo de auxinas, citoquininas y giberelinas como las más importantes fitohormonas en acción.
Para hacer mucho más fácil este complejo análisis y cuidar los márgenes técnicos y manejos culturales, se describe cada una definiendo distintos momentos de acción en función del desarrollo y evolución hasta cosecha.
Auxinas y su acción de mejorar la retención de fruta.
Las auxinas tienen relación directa con el activo crecimiento de tejidos de órganos reproductivos y vegetativos, y la síntesis en las plantas está a cargo de los meristemas juveniles tanto de brotes, como de flores y frutos.
En el desarrollo del fruto se reconoce una acción directa en la etapa I de división celular y etapa III de elongación celular, sin embargo, en ambas etapas su acción es secundaria y nunca más importante que la de citoquininas y giberelinas respectivamente.
Sin embargo, ya con muchas experiencias en investigación práctica, la acción de las auxinas se ha relacionado con la retención de fruta una vez fecundada las flores por el antagonismo con el ácido abscísico (ABA), que es la fitohormona de la senescencia.
Un tipo de auxina de síntesis como el Diclorprop-P (Stone Gross®) ha demostrado en cerezos que, aplicado temprano, entre los estados de ramillete expuesto y botón blanco, influyen positivamente en la retención de fruta cuajada y en proceso de desarrollo, disminuyendo al final del proceso la caída de frutos y asegurando la producción.
Se debe aclarar que el modo de acción de las auxinas no es aumentar la fecundación y cuaja mediante procesos asociados, sino que influir en la retención del fruto una vez cuajado y en pleno desarrollo. Un estudio de El-Sharkawy et al. (2018) demostró que la aplicación de auxinas en la fase de desarrollo de los frutos resultó en una mayor retención de los mismos, lo que se tradujo en un aumento en la cantidad de fruta cosechada.
Aminoetoxivinilglicina (AVG-ReTain®) como alternativa complementaria a una mejora de cuaja de frutos.
El trabajo específico de dar mayores opciones de aumentar la cuaja es entendido como la vía de reducir las tasas de etileno, que se traduce en prolongar la viabilidad, en un estado temprano de floración mediante algún compuesto exógeno como es el caso específico de Aminoetoxivinilglicina (AVG-ReTain®).
Trabajos realizados en Chile han demostrado que la aplicación temprana, en aproximadamente un 20-30% de flores abiertas, presentan un aumento de producción en variedades donde la problemática es la falta de fecundación, medido como cuaja inicial (10-15 DDPF) y finalmente con respuesta directa en el aumento de la producción. Esta problemática se explica principalmente por causas genéticas asociadas a variedades de difícil fecundación y cuaja, como por ejemplo Bing, Kordia y Regina entre otras, y muchas veces sobre portainjertos muy vigorosos que exacerban aún más el problema de cuaja. Incluso existen antecedentes positivos de su utilización en variedades auto fértiles y de buena producción, como Santina, cuando se enfrentan a condiciones climáticas desfavorables para la cuaja.
Claramente la utilización y éxito de este compuesto es complementario a otras acciones culturales como iluminación, utilización de variedades polinizantes compatibles, utilización de abejas y/o abejorros, además de coincidir con buenas condiciones climáticas al momento de la floración.
Citoquininas potenciando la etapa de división de células.
Las citoquininas son sin duda las fitohormonas que más están ligadas al proceso de división celular, que en la especie podría extenderse hasta unos 25-30 días después de plena flor (DDPF), aunque hay antecedentes científicos que podría comenzar ya a partir de ramillete expuesto previo al estado de botón blanco.
Desde un tiempo a la fecha se han utilizado distintas fuentes de citoquininas naturales mediante aplicaciones foliares desde plena flor, especialmente utilizando zeatinas, beatinas, entre otras, con efectos positivos en aumentar tamaño de frutos en la etapa I de división celular y que serían inductores de las propias citoquininas generadas por las plantas.
Antecedentes dados a conocer en Chile sobre la utilización de Tidiazurón (TDZ) y Forclorfenurón (CPPU) aplicados entre 5-7 DDPF han mostrado resultados en aumentar el peso y diámetro de frutos y una mejora en la proporción de fruta en calibres mayores a 28 mm (Súper Jumbo – 2J) comparado a un testigo en distintas combinaciones variedad/portainjerto. A su vez, mostraron resultados favorables en materia seca de frutos y firmeza (durofel), sin efectos negativos en color de cubrimiento, solidos solubles y condición de fruta en poscosecha.
Tener en consideración que altas concentraciones y dosis erróneas de citoquininas sintéticas, podrían alterar el desarrollo de la madurez o índice de color.
De todas formas, este tipo de citoquininas de síntesis no debieran reemplazar las aplicaciones de citoquininas naturales, ya que serían un complemento como precursores de la acción de la propia síntesis de las plantas.
Es importante recordar que el periodo de división celular es el más importante en la formación del fruto y será en esta etapa donde se forma una base fuerte de materia seca, concentración de solidos solubles que serán muy importante al momento de evaluar condición y calidad de fruto.
Giberelinas (ProGibb) y la última oportunidad de potenciar el tamaño y condición de fruta.
Muchos coinciden que es la fitohormona que está más familiarizada con los manejos generales de la producción de cerezas.
Su modo de acción se basa principalmente potenciando proceso de elongación celular en frutos ya formados, específicamente desde inicio de la etapa III de desarrollo del fruto, reconocido en la práctica desde el cambio de color de verde a amarillo, conocido comúnmente como color “pajizo”.
Se debe tener en cuenta que el gran aporte endógeno de giberelinas lo tiene la propia semilla del fruto.
Se reconoce que la aplicación de ácido giberélico (en este caso del tipo AG3) tiene un efecto positivo y directo a al aumento en tamaño de los frutos cuando se le incorpora foliarmente en la etapa de elongación de células.
Las dosis, en base a una concentración conocida de partes por millón (ppm) dependerán, en parte del cultivar. En cuanto a su susceptibilidad al cracking, a la complejidad de tener un adecuado color de cubrimiento y al estado de carga. Está muy estudiado que las aplicaciones de GA3 o AG3 y su efecto al tamaño de fruto podrían jugar en contra aumentando las partiduras de fruto no solo por efectos de la lluvia (mayor calibre, más partidura), a un desordenado desarrollo de color y a la capacidad genética de cada cultivar a aportar buen tamaño de fruto de forma natural. Por su parte, tiene efectos positivos sobre la disminución de defectos en la epidermis de la fruta como son pitting, machucones y rugosidad.
Sin embargo, en recientes estudios chilenos, se ha demostrado que altas concentraciones de ácido giberélico podrían actuar desfavorablemente sobre la estabilidad del tejido del pedicelo, respondiendo con deshidratación anticipada, lo que es un importante defecto de calidad en destino.
Por otra parte, según un estudio de Kato et al. (2015), la aplicación de giberelinas antes de la floración puede romper la dormancia de las yemas, lo que resulta en una floración más uniforme y abundante.



References.
Bangerth, F. 2000. Abscission and thinning of young fruit and their regulation by plant hormones and bioregulators. Plant Growth Regul.31:43-59.
El-Sharkawy, I., El-Metwally, I. M., & El-Sayed, A. 2018. Effect of auxin application on fruit drop and yield of sweet cherry (Prunus avium L.). Journal of Horticultural Science & Ornamental Plants, 10(1), 1-8.
Else, M.A., Stankiewicz, A.P., Crisp, C.M., Atkinson, C.J. 2004. The role of polar auxin transport through pedicels of Prunus avium L. in relation to fruit development and retentionJ. Exp. Bot.55: 2099-2109.
Fichet T. 2003. Biosíntesis y modo de acción de las giberelinas (GAs). Aconex (Chile) 78: 15-20.
Frank G. Dennis, Jr. 1.996. Fruit set. En Tree Fruit Physiology. Growth & Development. (pp. 99-107). Yakima, Wa. USA. Good Fruit Grower, Washington State Fruit Comission.
Gil G. 1.999. Hormonas vegetakes y reguladores Biológicos. En Fruticultura, El Potencial productivo (pp. 52-57). Santiago de Chile. Editorial Pontificia Universidad de Chile.
Kato, Y., Takahashi, H., & Matsumoto, S. 2015. Effects of gibberellins on flowering and fruit set in sweet cherry. HortScience, 50(5), 678-683.
Tapia C. 2017. Use of 2,4 DP – Diclorprop-p to improve fruit retention in Sweet Cherry (Prunus avium L.). 8th Sweet Cherry Simposium. Yamagata, Japón.Tapia C. 2017. AG3-gibberellic acid applications on fruit development stage III to increase fruit size at harvest and improve postharvest fruit condition in sweet cherry (Prunus avium L.). 8th Sweet Cherry Simposium. Yamagata, Japón.








